CBG/LAREB en "de bijsluiter" van vaccins
10 juli 2024 door Michael Smulders
De bijsluiters van vaccins worden nooit uitgereikt bij de (massale) vaccinatie (campagnes). Er is wel een plaats waar we deze kunnen inzien, het CBG. Melders van bijwerkingen zien hun klacht vaak niet terug, noch bij het LAREB, noch in de bijsluiter, waar het CBG de eindverantwoordelijkheid voorheeft. Wie schrijft die bijsluiters en wat komt er wel of niet in?
Het College ter Beoordeling van Geneesmiddelen (CBG) is een zelfstandig bestuursorgaan (zbo) binnen de Rijksoverheid, onder verantwoordelijkheid van het ministerie van Volksgezondheid, Welzijn en Sport. Het College is verantwoordelijk voor handelsvergunningen van medicijnen, volgens de Geneesmiddelenwet. (https://www.cbg-meb.nl/onderwerpen/over-cbg-het-college)
Het CBG schrijft over zichzelf:Iedereen die een medicijn gebruikt moet daarop kunnen vertrouwen. Dit is waar het College ter Beoordeling van Geneesmiddelen (CBG) elke dag aan werkt. Als onafhankelijke autoriteit reguleert het CBG de kwaliteit, werking en veiligheid van een medicijn, en stimuleert het CBG het juiste gebruik door de juiste patiënt
Verschillende bijsluiters vertellen een verschillend verhaal.
Er wordt nog wel eens in discussies verwezen naar “in de bijsluiter staat”, maar eigenlijk is er maar één echte bijsluiter, dat is het SmPC document op de EMA-site. Dat is soms, en met name bij het Pfizer mRNA, een monsterlijk document en in de praktijk wordt er vaak gekeken naar bijvoorbeeld het Farmacotherapeutisch Kompas waar we een praktische samenvatting van veel SmPC’s zien.
In Figuur 1 een print uit de info van het CBG, waarop te lezen is waar je de belangrijkste informatie kunt vinden, van de meest praktische tot de meest uitgebreide.

De PDF SmPC, etiket en bijsluiter.
Van ieder geneesmiddel is een PDF te downloaden met een algemene aanduiding:SmPC ('Summary of Product Characteristics'), etiket en patiëntenbijsluiter
https://www.geneesmiddeleninformatiebank.nl/ords/f?p
Het document is als volgt opgebouwd (figuren 2a en 2b)

De patiëntenbijsluiter is doorgaans opgebouwd op een eenvormige manier, hier weergegeven in figuur 2b.

De bijsluiter: groeiende informatie
Van de informatie die over een geneesmiddel te vinden is, is de publieksbijsluiter een dynamisch gedeelte. Immers, bepaalde eigenschappen van een medicijn of geneesmiddel zullen pas duidelijk worden in de dagelijkse praktijk, omdat de fabrieksinformatie niet verder gaat dan de beperkte observaties tijdens onderzoek en ontwikkeling van een geneesmiddel of vaccin.
Hierover lezen we op de CBG-site:
Dit doet het CBG door middenin de samenleving te staan, in alle openheid en in directe samenwerking met patiënten, artsen, apothekers en wetenschappers.
Naast nader onderzoek zal de patiëntenbijsluiter steeds vollediger worden gemaakt via een actieve rol bij hulpverleners en patiënten, door middel van het melden van “bijwerkingen” (bij het LAREB).
Verschil tussen vaccins en geneesmiddelen bij de informatieverstrekking.
Bij vaccins is meestal een apart PDF “patiëntenbijsluiter” niet aanwezig, maar is deze te vinden als laatste hoofdstuk van het document SmPC, etiket en patiëntenbijsluiter. Bijsluiterteksten kunnen kort zijn (1 A4tje) maar ook wel eens 10 pagina’s beslaan.
Bij vaccins heeft het CBG in samenwerking met de KNMP en het RIVM korte versies van de bijsluiter gemaakt die ook visueel aantrekkelijke zijn: https://www.cbg-meb.nl/onderwerpen/medicijninformatie-vaccinaties/vaccins-in-het-kort.
Daarmee lijkt het CBG tegemoet te komen aan de behoefte aan informatie die bij vaccins dus enigszins verstopt zit en ook soms erg uitgebreid is. Het meest prangende voorbeeld daarvan is het Pfizer mRNA vaccin ‘comirnaty’. De PDF is 500 bladzijdes en in dit document bevindt zich de patiëntenbijsluiter van blz. 364 tot 485, 121 bladzijdes!
De taken van het LAREB
In het jaar verslag 2023 van het LAREB lezen we:
Lareb voert voor het College ter Beoordeling van Geneesmiddelen (CBG) eendeel van de wettelijke taken uit op het gebied van de geneesmiddelenbewaking (verzamelen, registreren en analyseren van meldingen over bijwerkingen van geneesmiddelen door medische beroepsbeoefenaren en patiënten), zoals vermeld in de toelichting op de Geneesmiddelenwet. Deze taak wordt gefinancierd door het CBG.
Deze taak, farmacovigilance, heeft het LAREB sinds 1991 dus ook voor vaccins.
LAREB ontstond in de jaren tachtig vanuit het Regionale Evaluatie Bijwerkingen Systeem, op initiatief van apotheker Fred de Koning. Aanleiding voor de registratie waren de dramatische gevolgen van het gebruik van het geneesmiddel Softenon.
LAREB staat voor: LAndelijk (bureau voor) Registratie (en) Evaluatie (van) Bijwerkingen.
Het LAREB is dus niet alleen een meldpunt maar ook een bureau voor evaluatie.
Hoe werkt het farmacovigilance systeem eigenlijk?
Burgers, boeren en buitenlui, wie meldt?
Burgers kunnen melden, maar artsen (health care professionals) moeten melden (wettelijke verplichting juist als het gaat om een ernstige bijwerking. Artikel 78, 3. https://wetten.overheid.nl/BWBR0021505/2024-01-01/#Hoofdstuk 8.
Dat zijn reacties bij de patiënt die leiden tot een levensbedreigende situatie die medisch ingrijpen, opname in een ziekenhuis, invaliditeit, congenitale afwijkingen of de dood tot gevolg hebben. De praktijk wijst uit dat artsen terughoudend zijn met melden, enerzijds omdat het een hoop werk is, anderzijds omdat het een indirecte aanleiding kan zijn tot een claim.
Ten slotte de farmaceutische industrie. Comirnaty zit nog in fase 4, maar ook na fase 4 heeft Pfizer de verplichting omtrent werking en bijwerkingen actief te onderzoeken en te publiceren (postmarketing surveillance). Tot 2020 was 70% van de meldingen van de farmaceutische industrie, dit percentage daalde percentueel en absoluut in de corona periode.
Europese databank EudraVigilance: explosie van meldingen over de Covid-19 vaccins
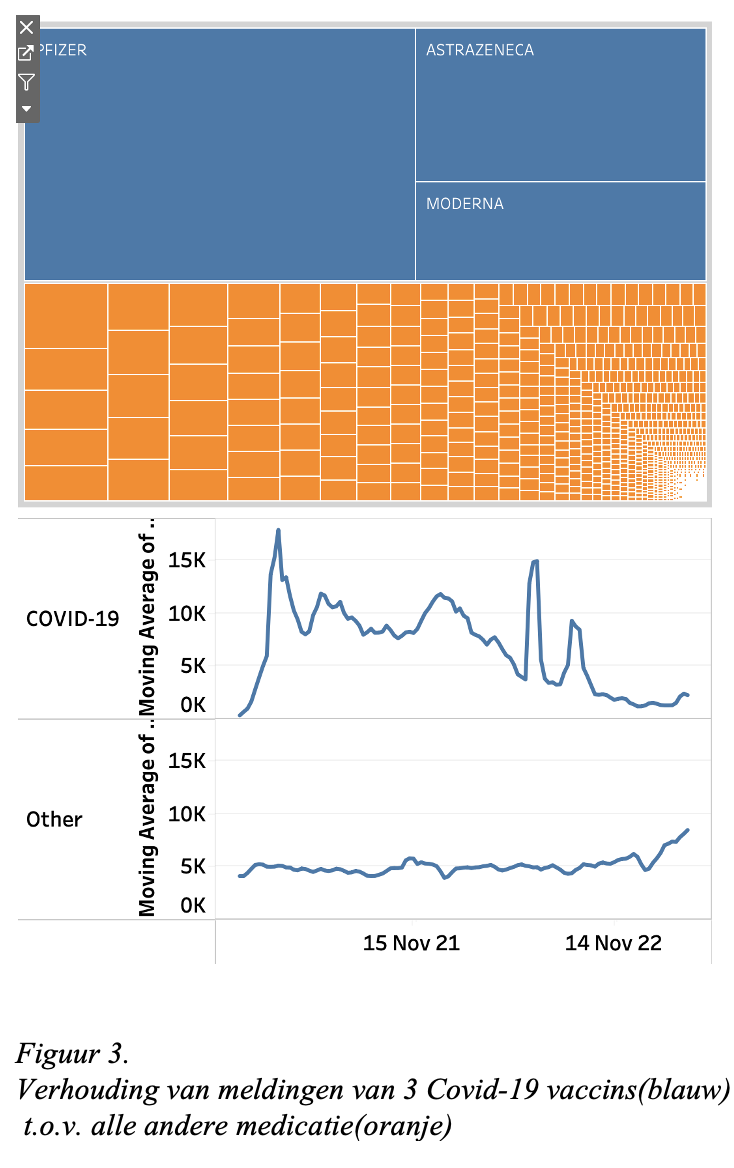
Na de uitrol van de Covid-19 vaccins steeg het aantal meldingen in Europa spectaculair. De verhoudingen worden weergegeven in figuur 3 weergegeven in de vorm van tegeltjes: de 3 blauwe zijn van de COVID-19 vaccins, de talloze oranje staan voor alle andere vaccins en geneesmiddelen.
De verzamelde Pfizer, AstraZeneca en Moderna vaccins zijn goed voor 50% van alle meldingen vanaf 4 januari 2021 tot mei 2023 in het EudraVigilance systeem. Het moge duidelijk zijn dat er een spectaculaire groei van meldingen plaatsvond na het uitrollen van de Covid-19 vaccinaties.
Er is een verschil tussen meldingen en bijwerkingen.
Burgers melden een klacht die zij vaak duidden als een bijwerking. Het herhaald optreden van een melding kan na onderzoek leiden tot het vermelden van deze verschijnselen als bijwerking op de bijsluiter; in engere zin is dit dus de taak van het CBG. Er zijn naast deze “erkende” bijwerkingen een veelvoud van klachten/verschijnselen die gemeld worden door patiënten, welke na onderzoek volgens het LAREB niet toegeschreven kunnen worden aan de inname of toediening van de stof(fen) in kwestie. Deze klachten verschijnen dus niet op de bijsluiter.
Een bijwerking kun je dus definiëren als een klacht/ongewenst verschijnsel optredend na een ingenomen medicijn of toegediend vaccin, wat toegeschreven wordt aan een (ongewenste) werking van de stof(en) in kwestie.
Fase 4 en later: aanvullingen op de bijsluiter.
De bijsluiter zoals die door de farmaceutische industrie wordt opgesteld is de neerslag van hetgeen gevonden is in de 4 fasen van onderzoek die een medicament/vaccin moet doorlopen voordat het geregistreerd wordt. De Covid-19 vaccins kregen een voorlopige toelating, omdat ze fase 3 nog niet doorlopen hadden.
Fase 4 is de fase waar bij de stof(fen) in kwestie breed in de populatie worden toegepast. Je zou kunnen zeggen dat deze fase nooit afgesloten kan worden: immers juist het breed toepassen, nadat het middel geregistreerd is, betekent dat de stof(fen) door alle mensen, ongeacht leeftijd, geslacht of bestaande aandoening of comedicatie gebruikt word(en).
De farmaceutische industrie is verplicht een zogenaamde ‘post marketing surveillance’ uit te voeren, waarbij de bijwerkingen die we eerst in de dagelijkse praktijk in beeld krijgen, alsnog toegevoegd kunnen worden aan de bijsluiter.
Soms roept het LAREB op tot het melden: ‘actieve surveillance’, LIM. LAREB Intensive Monitoring, https://www.lareb.nl/image-widget/onderzoeken, maar veelal wordt de database van het LAREB gevuld met spontane meldingen. Hoewel er becijferd is dat nooit meer dan 10% van de reacties na medicaties of vaccins gemeld worden, leidde deze passieve surveillance bij het Pfizer mRNA vaccin tot meer dan honderdduizend meldingen in Nederland en miljoenen meldingen in Europa (EudraVigilance) en de VS (VAERS).
Meldingen worden via de MedDRA (Medical Dictionary for Regulatory Activities) thesaurus (woordenboek van klachten) toegevoegd, https://en.wikipedia.org/wiki/MedDRAaan de SOC (System Organ Classification).Het MedDRA woordenboek is georganiseerd met een hiërarchie van vijf niveaus. Het hoogste of breedste niveau is de systeem/orgaanklasse (SOC),

Wanneer komen meldingen uiteindelijk in de bijsluiter?
Over de gang van zaken kunnen we het volgende lezen op de site van het LAREB.
Wat doen jullie met mijn melding?
Wij bekijken jouw melding en voeren een analyse uit als de melding daar aanleiding voor geeft. Dan kijken wij bijvoorbeeld naar:
- Hoeveel meldingen er zijn binnengekomen (ook in andere landen).
- Hoelang het duurde voordat de klachten ontstonden.
- Of er een logische verklaring is voor de klachten.
- Hoe vaak de klachten normaal gesproken voorkomen.
- Of andere oorzaken ook een rol gespeeld kunnen hebben.
- Wat er over de mogelijke bijwerking in wetenschappelijke onderzoeken te vinden is.
Komt mijn melding op jullie website?
Jouw gemelde bijwerking komt anoniem op onze website bij het betreffende medicijn of vaccin samen met de andere meldingen. Op de homepagina kun je bij 'Meldingen bekijken" zoeken op het geneesmiddel of vaccin.
Komt mijn bijwerking in de bijsluiter?
De bijwerking die je bij ons meldt, komt niet automatisch in de bijsluiter te staan. Wij bekijken en analyseren meldingen. Als onze analyses leiden tot nieuwe kennis over bijwerkingen, dan verspreiden wij die kennis en delen wij deze met het College ter Beoordeling van Geneesmiddelen (CBG), het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) en/of de Nederlandse Voedsel- en Warenautoriteit (NVWA). Deze instanties besluiten of zij maatregelen nemen, zoals de bijwerking toevoegen aan de bijsluiter.
Wanneer analyses leiden tot nieuwe kennis over bijwerkingen, dan verspreiden wij die kennis zo veel mogelijk. Bijvoorbeeld via onze website, sociale media, nieuwsbrief, wetenschappelijke en niet-wetenschappelijke tijdschriften voor patiënten en algemeen publiek, en via beroepsverenigingen en patiëntenorganisaties.
Wij informeren ook het College ter Beoordeling van Geneesmiddelen (CBG) via signaleringen. Bij vaccins informeren wij ook het Rijksinstituut voor Volksgezondheid en Milieu (RIVM), en bij gezondheidsproducten de Nederlandse Voedsel en Warenautoriteit (NVWA). Deze instanties kunnen vervolgens maatregelen nemen. Bijvoorbeeld de bijsluiter aanpassen, aanscherpen wie het geneesmiddel mag gebruiken of het vaccin mag krijgen, of een middel van de markt halen.
Op haar site schijft het LAREB over haar werkwijze (LAREB jaarverslag 2020 ) het volgende:
Alle binnengekomen meldingen controleert Lareb op volledigheid en mogelijke onduidelijkheden. Indien gewenst wordt extra informatie bij de melder en/of de behandelend zorgverlener opgevraagd. De melding wordt ingevoerd in de databank, voorzien van alle noodzakelijke gegevens. Bijwerking en geneesmiddel worden daarbij gecodeerd volgens de geldende (internationale) standaarden.
De meldingen vanuit de farmaceutische industrie (MAH) worden automatisch vanuit de Eudravigilance databank van de EMA naar de Lareb databank geïmporteerd, om zo een volledig inzicht in alle Nederlandse meldingen te krijgen. Op die manier worden alle meldingen meegenomen voor signaaldetectie.
Zoals boven al gezegd, meldingen worden via de MedDRA (Medical Dictionary for Regulatory Activities) thesaurus (woordenboek van klachten) toegevoegd (https://en.wikipedia.org/wiki/MedDRA) aan de SOC (System Organ Classification). Het MedDRA woordenboek is georganiseerd met een hiërarchie van vijf niveaus. Het hoogste of breedste niveau is de systeem/orgaanklasse (SOC). Bij het LAREB vinden we hier een Nederlandse versie van.
Het is van belang om op te merken dat de verwerking van de meldingen, ook die van de burger, bij het LAREB geautomatiseerd verloopt.
Het LAREB schrijft op haar site:” indien gewenst wordt extra informatie opgevraagd”. Herhaaldelijk is door burgers gemeld dat zij hun klacht niet of onder een ander hoofd terugvinden in de tabellen van het LAREB. Bijvoorbeeld de specifieke diagnose ‘migraine’ onder ‘hoofdpijn’, zelfs als deze meldingen vergezeld gingen van medische rapportages van specialisten uit het ziekenhuis. Dit is te verklaren uit de geautomatiseerde verwerking. Het is dus niet zo dat iedere melding persoonlijk opgemerkt, geanalyseerd en afgehandeld wordt.
Het laat zich aanzien dat het LAREB overspoeld is met meldingen en dat de uitbreiding van het aantal FTE’s daarmee niet gelijke tred heeft gehouden. Daarin staat het Lareb niet alleen, ook het VAERS is beschreven in het BMJ als een organisatie die verre van adequaat (Is the US’s Vaccine Adverse Event Reporting System broken?BMJ 2023; 383 doi: https://doi.org/10.1136/bmj.p2582 (Published 10 November 2023) in staat is om de stortvloed van meldingen bij te houden.
Meldingen zijn evident niet eenduidig weggeschreven. Wie bijvoorbeeld de aan het hart gerelateerde meldingen wil vinden, zal dus de hele database moeten doorzoeken om een volledig beeld te krijgen.
Voor het aanvullen van de publieksbijsluiter tekst zijn dus 4 dingen nodig:
1 melden door hulpverleners en gebruikers
2 registratie door het LAREb
3 onderzoek
4 actie van het CBG om de bijsluitertekst aan te passen.
De NVKP (Nederlandse Vereniging Kritisch Prikken) startte in 2024 een petitie voor een wettelijke verplichting om bij vaccinatie een schriftelijke bijsluiter vooraf toe te sturen. Maar wat moetenhulpverleners en patienten in het kader van informed consent dan doornemen? Op de CBG-site zijn een aantal een “patiëntvriendelijke” bijsluiters geplaatst in de vorm van de “Vaccinaties in het kort”. Hierbij ligt de nadruk op relatief onschuldige, voorbijgaande en lokale bijwerkingen, terwijl (mogelijke fatale) bijwerkingen op langere termijn onvermeld blijven. De boodschap is duidelijk: “veilig en effectief”, de mantra waarmee steevast vaccinaties begeleid worden.
Maar is de surveillance van COVID-19 vaccins wel up to date?
Lees hierover de volgende blog: Cardiale bijwerkingen van Covid-19 vaccins.
Myocarditis en pericarditis staan in de bijsluiter, maar hoe zit dat met die "hartdoden", mensen die ineens zo maar neervallen, waar in de media nogal eens melding van wordt gemaakt ?
Den Bosch, juli 2024